Astrophotographie en palette « Hubble » (2/2)
La nature de la lumière
La lumière est un rayonnement électromagnétique. Ces rayonnements électromagnétiques sont des ondes, avec des caractéristiques qui leur sont propres (fréquence, longueur d’onde, phase). Sur Terre, nous « baignons » dans un environnement électromagnétique. Voici quelques exemples de rayonnements :
- La lumière bien sûr
- Le wifi de votre box internet
- Votre téléphone portable
- La radio, la TV
- Les télécommandes de vos appareils électroniques
- Les radars
- Les rayons X pour réaliser les radiographies à l’hôpital
- Etc etc.
Chaque exemple cité est lié à une gamme de rayonnements électromagnétiques qui lui est propre. Cependant, nous n’en percevons qu’une toute petite partie : ceux dont la longueur d’onde correspond à la lumière.
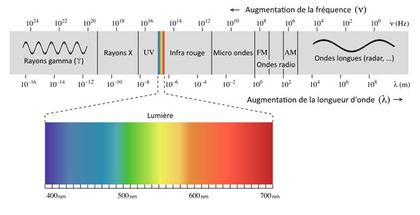
Plus la fréquence (nombre d’oscillations par secondes) de l’onde électromagnétique est importante, plus elle contient d’énergie. C’est pourquoi les rayons gamma (v. le schéma ci-dessus) sont très dangereux et qu’ils sont confinés dans d’épaisses carcasses de bétons dans les centrales nucléaires.
Cette énergie est délivrée lors de l’« impact » de l’onde sous la forme d’une petite particule dont le nom vous est sans doute familier : le photon.
L’origine de la lumière
Plusieurs mécanismes produisent des rayonnements électromagnétiques (et donc de la lumière). Les principaux sont les 2 suivants :
- Le rayonnement thermique. Quand un corps chauffe, il émet de la lumière dont la couleur est fonction de sa température. C’est ce qu’il se passe lorsque le maréchal ferrant travaille un fer : plus le fer est chaud, plus la lumière qu’il émet est bleue. Plus il va refroidir, plus sa couleur virera au rouge. La lumière émise par le Soleil a aussi pour origine un rayonnement thermique.
- La luminescence, qui est une émission de lumière dont l’origine n’est pas thermique. Elle est produite par l’excitation d’atomes (collision avec un autre atome, absorption d’un photon, etc.). C’est ce mécanisme qui nous intéresse ici car il se produit notamment dans les grandes structures gazeuses de l’univers (nébuleuses, chromosphère du Soleil…). Ce mécanisme de luminescence est aussi à l’origine des aurores polaires, j’y reviendrai au cours d’un prochain article.
Structure de l’atome : le modèle de Bohr - Rutherford
Il nous faut tout d’abord comprendre la structure de l’atome. Un atome est composé de particules : protons et neutrons forment son noyau, alors que des électrons gravitent autour. Attention, le modèle décrit ici est maintenant dépassé par les principes de la mécanique quantique, et n’est utilisé qu’à des fins pédagogiques.
Rutherford a été le premier a été le premier à attribuer une structure planétaire à l’atome : les électrons sont séparés par du vide et gravitent autour du noyau, comme les planètes autour du système solaire.
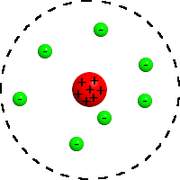
Niels Bohr a complété le modèle de Rutherford en y apportant les contraintes suivantes :
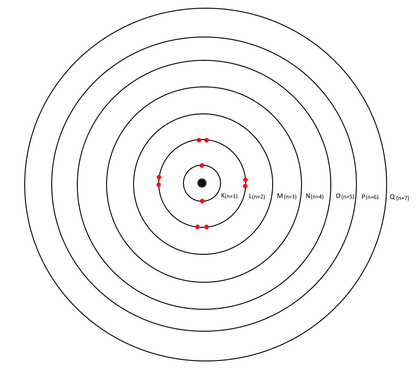
- Un électron ne peut se trouver que sur une orbite bien définie autour de l’atome : les couches électroniques.
- Les électrons ne peuvent pas changer de couche (à moins qu’ils ne soient excités, voir plus bas).
- Chacune de ces couches accueille un nombre précis d’électrons.
- Une couche ne peut accueillir des électrons qu’à condition que la précédente ait été remplie.
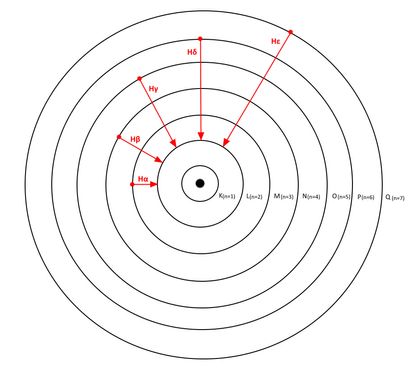
Il existe 7 couches électroniques différentes : la couche K est la plus proche du noyau (niveau 1, l’orbite « fondamentale ») alors que la couche Q est la plus éloignée (niveau 7). Chacune possède un niveau d’énergie noté « n ». L’énergie la plus basse est celle de la couche la plus proche du noyau (couche K, n= 1), la plus forte est celle de la couche la plus éloignée du noyau (couche Q, n=7).
La luminescence
Nous venons de voir que d’après Bohr, les électrons ne peuvent se trouver que sur des orbites bien définies autour du noyau de l’atome et qu’ils ne pouvaient en changer.
Sauf s’ils sont excités : choc avec une autre particule (photon, électron libre, etc.), choc avec un atome… Si l’énergie apportée est suffisante et n’est pas trop forte, Bohr précise que l’électron peut changer d’orbite, pour ensuite revenir à sa position d’origine. Mais pour revenir à sa position d’origine (une couche de niveau d’énergie moins élevée), l’électron doit libérer son excédent d’énergie sous forme de photon.
Le retour à l’orbite initiale de l’électron peut se faire en une ou plusieurs étapes :
- Retour à l’orbite initiale de proche en proche
- Retour à l’orbite initiale en une seule fois
- Ou retour à l’orbite initiale en sautant quelques orbites.
La longueur d’onde du photon émis sera propre au saut de retour effectué et à l’atome excité. Si la longueur d’onde du photon émis fait partie du domaine du visible (la lumière), alors nous percevrons une couleur.
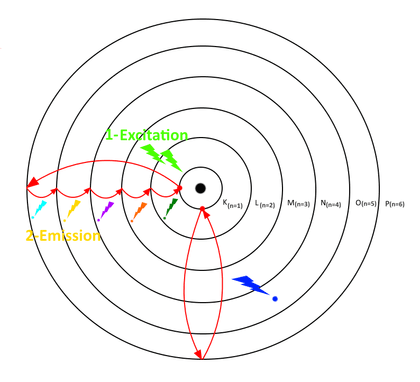
C’est ce mécanisme qui est à l’origine de la luminescence : excitation, puis émission d’un photon. Beaucoup de nébuleuses émettent de la lumière par luminescence : les gaz sont chauffés par les étoiles qui s’y trouvent. Les atomes du nuage de gaz s’agitent, s’entrechoquent. Les électrons changent alors d’orbite, puis reviennent à leurs positions initiales en émettant de la lumière.
Pour être complet sur la luminescence, sachez qu’il existe 2 types de luminescence :
- La fluorescence : l’émission est presque immédiate après l’excitation.
- La phosphorescence : l’émission se produit de plusieurs secondes jusqu’à plusieurs jours après l’excitation.
Le filtre Hα : étude de cas sur l’hydrogène
La plupart des nébuleuses sont constituées en très grande partie d’hydrogène. Mais étudions pourquoi le filtre utilisé en imagerie s’appelle « alpha », et non pas simplement « hydrogène ».
L’atome d’hydrogène
L’atome d’hydrogène est particulier : son noyau n’est composé que d’un seul proton, et il ne possède qu’un seul électron sur sa couche périphérique. Lorsqu’il est stable, celui-ci se trouve donc sur la couche K (la première).
La série de Balmer
Nous avons vu qu’après excitation, un électron cherche à retomber sur son orbite initiale en émettant un photon pour se débarrasser de son excès d’énergie. La longueur d’onde de ce photon dépend de l’atome, de la position de départ et de la position d’arrivée de l’électron.
Le physicien Johann Jacob Balmer a étudié l’ensemble des longueurs d’ondes des photons émis par l’hydrogène lorsque l’électron excité retombe sur la couche L (n=2). Ce qui donne les combinaisons suivantes :
| Niveau d’énergie haut | Niveau d’énergie bas | Notation usuelle | Longueur d’onde (nm) |
| 3 | 2 | Hα | 656 |
| 4 | 2 | Hβ | 486 |
| 5 | 2 | Hγ | 434 |
| 6 | 2 | Hδ | 410 |
| 7 | 2 | Hε | 397 |
Les longueurs d’onde Hα, Hβ, Hγ, Hδ ont la particularité de faire partie du domaine de la lumière visible. C’est pourquoi la série de Balmer est si intéressante. La raie Hα est de plus très intense dans les nébuleuses : ce filtre est donc extrêmement utilisé en astrophotographie.
Les couleurs émises sont les suivantes :

Les autres séries
Johann Balmer a étudié les longueurs d’ondes des photons émis lorsque les électrons retombent sur la couche de niveau 2. D’autres physiciens ont étudié ce qu’il se produisait lorsque l’électron retombe à un niveau d’énergie différent. Mais les longueurs d’ondes des photons émis ne font plus partie du visible…
| Nom de la série | Niveau d’énergie bas | Domaine |
| Lyman | 1 | UV |
| Balmer | 2 | UV / Visible |
| Paschen | 3 | IR |
| Balmet | 4 | IR |
| Pfund | 5 | IR |
| Humphreys | 6 | IR |
Les autres atomes
Même pour l’atome le plus simple (l’hydrogène, un seul électron), le problème est complexe. Il se complique avec les autres atomes, et encore plus avec les molécules. Jusqu’à même devenir hors de portée des ordinateurs les plus puissants…
Les milieux ionisés
L’ionisation
La charge d’un atome est toujours neutre car il comporte autant de protons (charge positive) que d’électrons (charge négative). Par conséquent lorsqu’un atome…
- Perd un électron, sa charge devient positive. C’est un ion positif.
- Gagne un électron, sa charge devient négative. C’est un ion négatif.
De nombreux atomes sont ionisés dans les nébuleuses. Dans ces milieux très agités, les sources d’excitation sont multiples : chocs entre atomes, excitations par des photons, etc. Si l’apport énergie est suffisant, certains électrons peuvent être propulsés au-delà de la dernière orbite d’influence du noyau de l’atome.
L’atome devient alors un ion positif, et les électrons perdus deviennent des électrons libres. Ceux-ci pourront ensuite se recombiner avec des ions négatifs pour reformer un atome stable.
Notation des degrés d’ionisation
Il existe plusieurs façons de noter l’ionisation d’un atome :
| Degré d’ionisation | Description | Exemple | Notation chimique |
| I | Non ionisé (neutre) | HI, HeI | H, He |
| II | Ionisation simple (perte d’un électron) | HII, HeII | H+, He+ |
| III | Ionisation double (perte de 2 électrons) | HeIII | He++ |
Les régions HII
Nous l’avons vu précédemment, les nébuleuses contiennent une grande majorité d’ions, et une grande partie d’entre elles sont composées essentiellement d’hydrogène. L’atome d’hydrogène ne pouvant être ionisé qu’une seule fois, c’est pourquoi les nébuleuses sont souvent nommées régions « HII ».
Précisions sur le rayonnement Hα
Il n’existe pas de filtre « HII » car les ions HII ne possèdent pas d’électrons (leurs uniques électrons ont été perdus). Ils ne peuvent donc pas émettre de photons lorsqu’ils sont excités.
Mais les électrons libres sont nombreux dans les nébuleuses. Si un ion HII rencontre un électron libre, celui-ci sera attrapé pour reformer un atome d’hydrogène stable : c’est la « recombinaison ».
Lors de cette recombinaison, l’électron peut se retrouver sur n’importe quelle orbite autour du noyau d’hydrogène. Lorsqu’il revient en cascade vers l’orbite de niveau 1 (la plus stable), il existe 50% de chance pour que l’électron réalise un saut de l’orbite de niveau 3 vers l’orbite de niveau 2. Un photon dont la longueur d’onde correspond à la raie Hα est alors émis. Cette raie est donc très intense lorsque l’on observe des nébuleuses.
Les filtres [OIII], [SII], [NII]…
Dans les nébuleuses, en plus de la raie Hα, des raies lumineuses très intenses de [NII] (azote ionisé), [OII], [OIII] (oxygène ionisé et doublement ionisé), [SII] (soufre doublement ionisé) sont aussi observées.
La notation « [] » correspond à une raie interdite, c’est-à-dire qu’elle ne peut pas être reproduite sur Terre. Pour que ces ions émettent de la lumière, ils doivent rester excités pendant plusieurs secondes à plusieurs heures. Ensuite seulement leurs électrons retourneront à leur position d’origine en émettant des photons.
Cet état d’excitation ne peut durer aussi longtemps sur Terre, car un atome excité peut transférer son surplus d’énergie dès qu’il rentre en collision avec un autre atome : c’est le mécanisme de désactivation collisionnelle. Il faut donc de parfaites condition de vide pour que des états d’excitation aussi longs se produisent. Ces conditions de vide ne sont pas reproduisibles sur Terre, même avec les meilleurs instruments. Mais ces conditions existent dans certaines nébuleuses…
Astrophotographie avec un réflex (ou un hybride…)
Pour vous aider à débuter ou progresser en astrophotographie avec votre réflex ou votre hybride, j’ai réuni en un livre électronique de 215 pages des techniques issues de plus de 15 années de pratique de la discipline.
📚 Au sommaire :
- Pour chaque thème, des expériences terrain et un tutoriel détaillé de traitement avec Photoshop.
- Voie lactée et arches de Voie lactée.
- Aurores boréales.
- Pluies d’étoiles filantes.
- Ciel profond (nébuleuses, galaxies…) (43 pages).
- Lune et comètes.
- Visites virtuelles.
- Imprimer ses astrophotographies.
- …


